

Tossicità e Tossicologia
| |
. Elenco dei principali articoli di My-personaltrainer.it che affrontano il tema "Tossicità e Tossicologia". Avvelenamento da funghi velenosi Fitoterapia: i rischi del naturale Tossicologia dei metalli pesanti
|
|
In questo articolo si analizzano alcune tossine presenti negli alimenti, in grado di sviluppare degli effetti avversi nel nostro organismo. Queste sostanze tossiche sono:
LECTINE: le lectine sono proteine, glicoproteine o lipoproteine, che fanno parte della famiglia vegetale delle fitoemaglutinine, così chiamate perché favoriscono l'aggregazione dei globuli rossi. Quest'ultime si ritrovano nei semi di circa ottocento piante, di cui seicento della famiglia delle leguminose. Una volta ingerite, vanno a legarsi alle cellule dell'epitelio intestinale, riducendo la capacità assorbente dell'intestino. Normalmente, queste proteine vengono inattivate con la cottura. GLUCOALCALOIDI: i glucoalcaloidi derivano da alcune solanacee come le patate, le melanzane ed i pomodori. Le sostanze in esame - che si possono sviluppare ed accumulare all'interno di queste piante - sono le solanine. Un'eccessiva introduzione nell'organismo di solanine (dosaggio superiore ai 20 mg per 100 grammi di solanacea) può provocare un'azione irritante ed inibire l'azione dell'acetilcolinesterasi. ACIDO OSSALICO: lo ritroviamo principalmente in pomodori, spinaci, tè e cacao. L'acido ossalico è tossico perché lega il calcio rendendolo non più disponibile al nostro organismo; inoltre i cristalli di calcio che precipitano provocano dei danni al tessuto renale e vasale. Anche in questo caso è molto difficile assumere una quantità di acido ossalico tale da causare questi effetti, proprio perché i quantitativi da assumere sono molto alti (si parla di più di due chili di pomodori e più di mezzo chilo di spinaci). ACIDO FITICO: lo si ritrova nei cereali, nei legumi e nella frutta secca. L'acido fitico lega i metalli bivalenti e trivalenti, importanti per il funzionamento cellulare. L'acido fitico può quindi ridurre l'assorbimento di rame, zinco, ferro e calcio. AMINOACIDI TOSSICI: questi aminoacidi “anomali o atipici” sono ben diversi dagli aminoacidi classici impiegati per la formazione delle proteine. Una maggiore introduzione di questi amminoacidi anomali provoca il NEUROLATTIRISMO. I principali responsabili di questa conseguenza sono il DABA (acido L-2,4-diamminobutirrico) e l'ODAP (acido 3-N-ossil-diamminopropionico), presenti soprattutto nei semi della cicerchia. Il neurolattirismo è caratterizzato da debolezza e rigidità muscolare muscolare, sino alla paralisi degli arti inferiori. Un'altra patologia molto pericolosa è il FAVISMO. Questa patologia è caratterizzata dalla carenza di un enzima, che è il glucosio-6-fosfato-deidrogenasi. Un individuo che presenta il favismo riesce a produrre soltanto piccole quantità di NADPH (necessario, tra l'altro, per il funzionamento del glutatione, quindi utile per l'azione antiossidante e per l'integrità dei globuli rossi). Per questo motivo, quando le persone affette da favismo assumono delle piccole quantità di alimenti, come le fave, che contengono l'aminoacido tossico 3,4-diidrossifenilalanina, possono andare in contro ad emolisi dei globuli rossi e nei casi più gravi anche a morte. COMPOSTI CIANOGENETICI: queste tossine alimentari si trovano soprattutto nei semi racchiusi nel nocciolo, come quello della pesca, dell'albicocca o della ciliegia. Un esempio di composto cianogenetico è dato dall'amigdalina, un glicoside in grado di produrre acido cianidrico. L'acido cianidrico è un veleno mitocondriale che ostacola la produzione di adenosintrifosfato (ATP), essenziale per il nostro organismo. SOSTANZE VASOATTIVE, come
la tiramina contenuta in alimenti fermentati, come formaggi, prodotti
lievitati, birra, vino e caffè. La tiramina è un'amina
simpatico-mimetica indiretta, in grado di svuotare le vescicole che
contengono la noradrenalina e l'adrenalina, provocando un rilascio massiccio
di questi neurotrasmettitori soprattutto a livello cardiaco e vasale.
La conseguenza è una crisi ipertensiva. In pazienti depressi,
la cui cura prevede la somministrazione dei MAO inibitori, la tiramina
non viene degradata causando ipertensione |
| Una sola mutazione non provoca il cancro; piuttosto, sono necessarie più mutazioni in zone molto critiche della cellula, come i geni ed il DNA. La cancerogenesi è un processo che porta alla formazione del cancro. Il cancro è un insieme di patologie caratterizzate da un incontrollato accrescimento di cellule anomale. Queste cellule danno origine ad una popolazione cellulare che - oltre alla capacità di riprodursi velocemente - possiede molte caratteristiche, come le capacità di resistenza e la possibilità di invadere sia gli organi ed i tessuti più vicini che quelli più lontani. La cancerogenesi può essere causata da agenti genotossici ed in tal caso si parla di CANCEROGENESI MUTAZIONALE. Tuttavia, la cancerogenesi può essere causata anche da agenti non genotossici o da agenti epigenetici, per cui viene chiamata CANCEROGENESI EPIGENETICA. Nella cancerogenesi mutazionale gli agenti genotossici e DNA-reattivi vanno a provocare una mutazione nella cellula sana. Questa mutazione provoca un'alterazione del materiale genico all'interno della cellula, quindi porterà alla formazione diretta di neoplasie. Nella mutazione epigenetica, invece, la cellula “sana” contiene già i geni per lo sviluppo del cancro. Questi geni inizialmente si presentano in modalità inattiva, però possono essere attivati dall'azione di particolari agenti promotori o epigenetici. Gli agenti
epigenetici possono essere degli ormoni (estrogeni coniugati), immunosoppressori,
sostanze allo stato solido (materiale plastico ed eternit/amianto o
asbesto), le TCDD (2,3,7,8-tetraclorurodibenzo-p-diossina, note come
diossine) e gli esteri del forbolo (tetradecanoilforbolo acetato, DDT).
I cancerogeni a loro volta possono anche classificarsi in:
Che cos'è il genotossico? Il genotossico è una sostanza che deriva da un progenotossico, il quale - per diventare tale ed indurre una mutazione - deve subire una bioattivazione metabolica. La stessa cosa si può applicare anche per il cancerogeno. Quindi il cancerogeno terminale deriva dal procancerogeno attivato con una bioattivazione. Ritornando al percorso dello sviluppo della cancerogenesi, se la cellula subisce una mutazione al materiale genico può ripararsi o andare in contro ad apoptosi. Se la fase di riparazione o la morte cellulare non ha avuto un buon successo, durante la replicazione della cellula mutata l'alterazione viene trasmessa a livello delle cellule figlie. Fortunatamente, la mutazione può essere silente ed in tal caso non c'è il verificarsi di neoplasie, ma se la mutazione ha colpito particolari geni della cellula (onco-soppressori o proto-oncogeni), quest'ultima si avvia verso la produzione di tessuto neoplastico. Lo sviluppo del tumore è regolato da due particolari proteine (geni) che sono:
Normalmente l'attività
di questi due geni è bilanciata; fanno cioè in modo di
controllarsi a vicenda e la cellula ha uno sviluppo controllato. Con
l'intervento di una mutazione che sbilancia tale equilibrio, avremo
un'elevata attività dei proto-oncogeni ed un'eccessiva riduzione
degli onco-soppressori. In seguito a questo sbilanciamento la cellula
va in contro a formazione neoplastica. Le tappe della cancerogenesi
La seconda tappa è quella di PROMOZIONE, che non è un qualcosa di positivo perché in questa fase le cellule iniziano tumore la loro moltiplicazione dando origine ad un raggruppamento di cellule con genoma modificato. Infine, la terza ed ultima
tappa è la PROGRESSIONE, che inizialmente si presenta con raggruppamento
di cellule benigne (neoplasia benigna), però con il passare del
tempo le cellule benigne si trasformano in cellule maligne, in seguito
all'intervento di altri promotori o altre mutazioni. |
Tossicologia dei metalli pesanti Per scaricare il documento completo sulla tossicologia dei metalli pesanti clicca qui
Piombo Effetti tossici •Inibizione enzimi
sulfidrilici
Intossicazione da Pb inorganico
Bande dense metafisi
Intossicazione da Pb organico
Trattamento
Arsenico
Intossicazione acuta
da
Intossicazione acuta da arsina
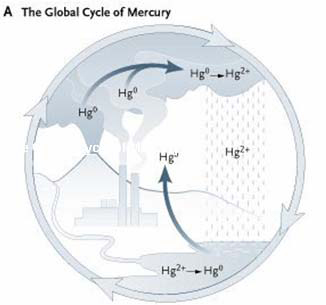
Esposizione al mercurio 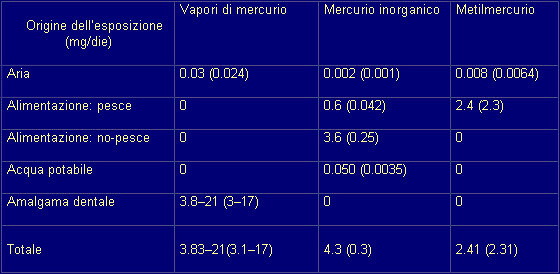
Meccanismi di tossicità
Neurotossicità
|
 |
 |
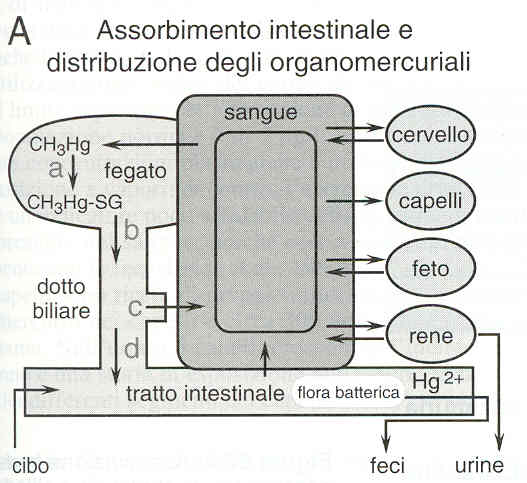
Tossicocinetica
•Mercurio
elementare
–Assorbimento polmonare
–Scarso assorbimento transcutaneo, orale
–Distribuzione SNC
–Escrezione urinaria
•Sali di mercurio
–Assorbimento orale
•catalasi
•conversione da mercurio elementare
–Accumulo renale
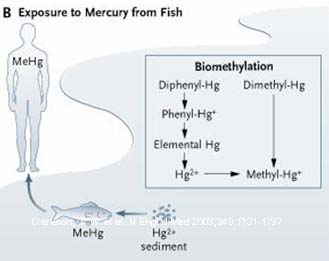
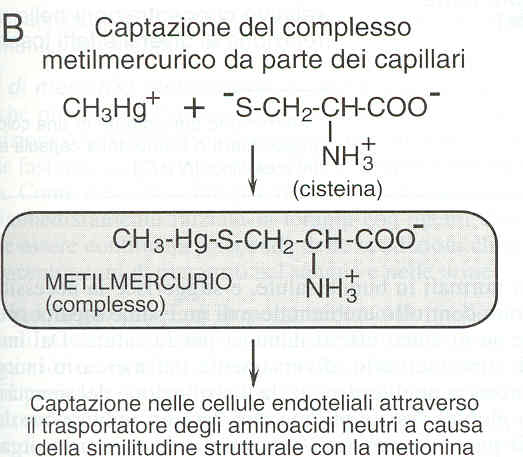
•Metilmercurio
–Assorbimento polmonare ed orale
–Distribuzione nel SNC
–Escrezione fecale
•Ricircolo enteroepatico
Metilmercurio
 |
 |
Intossicazione acuta
•Polmonite
ed edema polmonare
•Neuropatia
•Gastroenterite
–Sali di mercurio
•Necrosi tubulare renale
–Alterazioni glomerulari
Intossicazione cronica
•Tremori
•Disturbi neuropsichici
–Eretismo•Gengivostomatite
•Acrodinia–Eritema, dolore degli arti
•Neurotossicità fetale e neonatale
–Metilmercurio
–Ritardo psicomotorio
–Malattie neurodegenerative ?
•Tossicità cardiovascolare ?

Trattamento
•Vapori e mercurio inorganico
–Respirazione assistita
–Vomito
–Chelanti
•Dimercaprolo
•Penicillamina
•Succimer
•Metilmercurio
–Controindicati chelanti
•Transitorio aumento concentrazioni ematiche
–Resine politioliche
•Diminuito ricircolo enteroepatico
–Emodialisi
•Somministrando cisteina o succimer
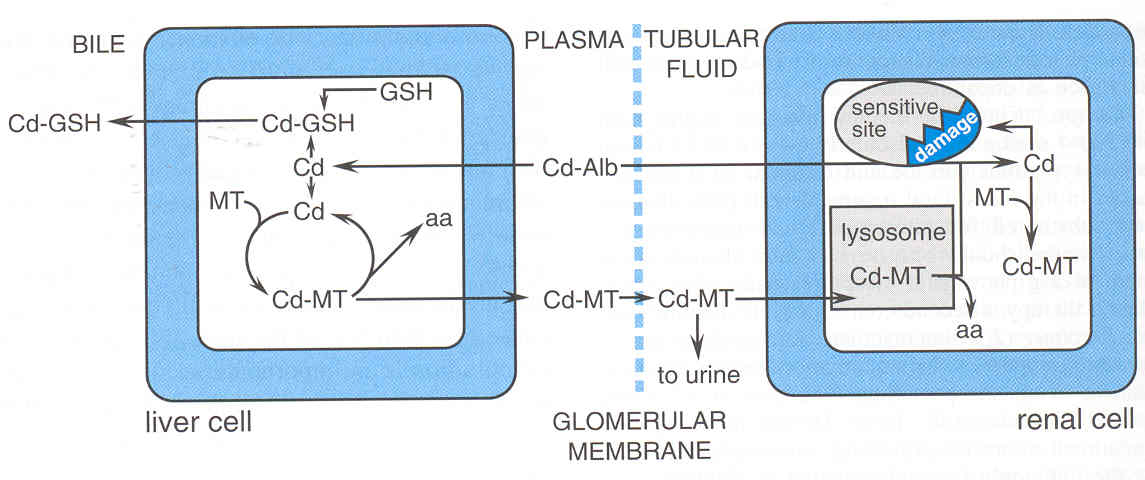
Cadmio
•Inquinante industriale
–assunzione maggiore per via inalatoria
•fumo di sigaretta
–accumulo in alimenti
•cereali, crostacei
•Nefropatia tubulare
–![]() ß2-microglobulina
urinaria
ß2-microglobulina
urinaria
–osteomalacia
•Ipertensione arteriosa
•Enfisema, fibrosi polmonare
–cancro polmone, prostata
•Terapia
–EDTA, dimercaprolo
Cadmio-metallotioneina
Tossicità renale
Ferro
|
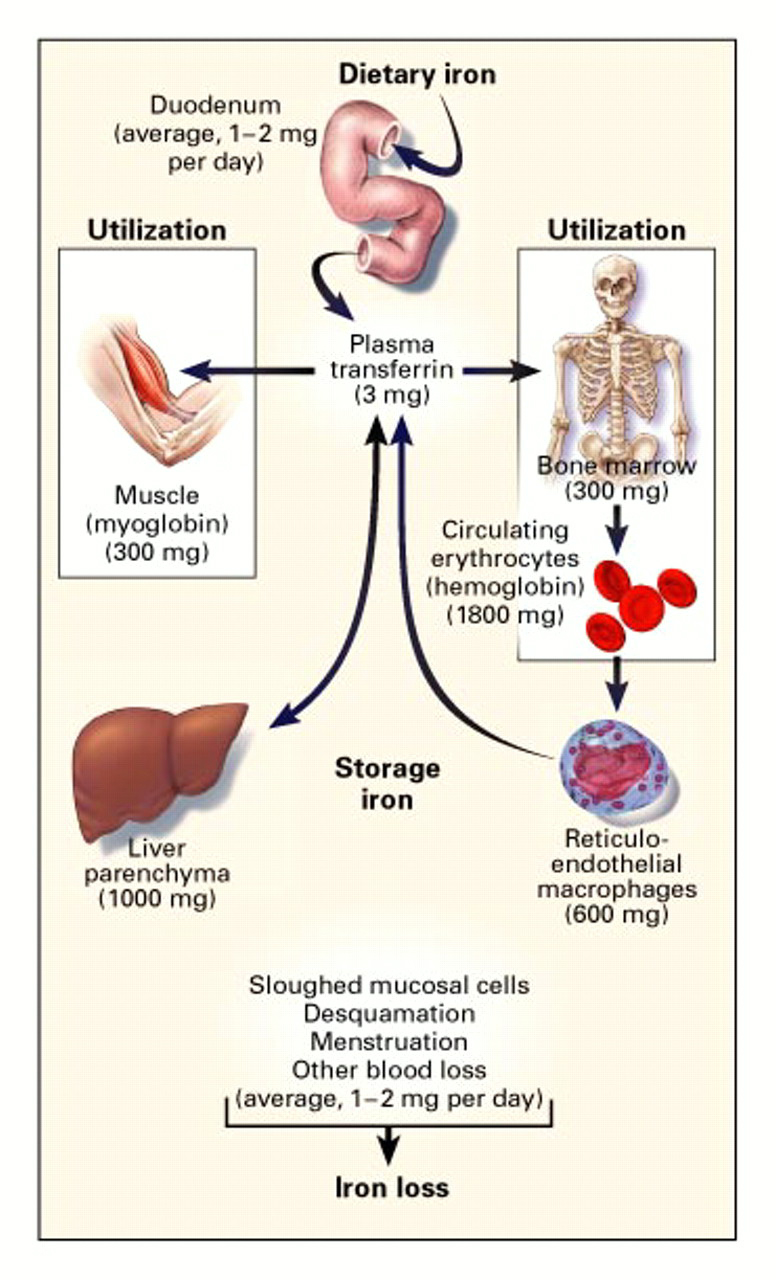 |
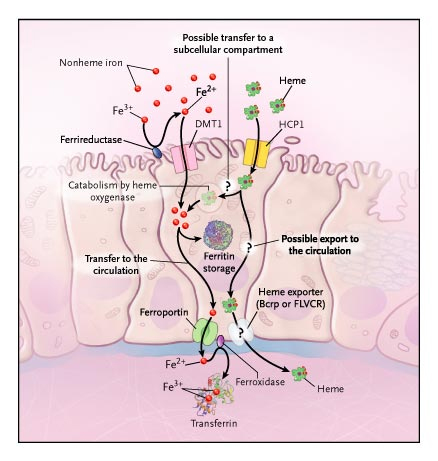
Assorbimento Ferro
| •Enterociti –CarrierFe2+ •DMT1 –Ferroportina –Carriereme •HCP1 –Bcrp –FLVCR – – |
 |
|
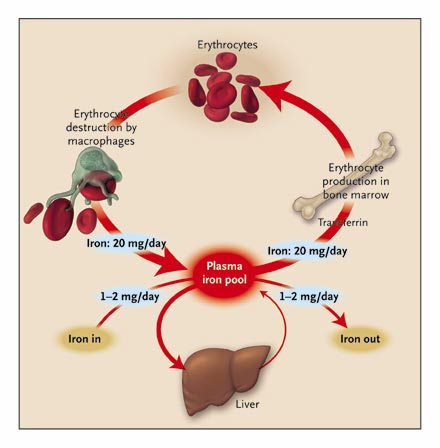
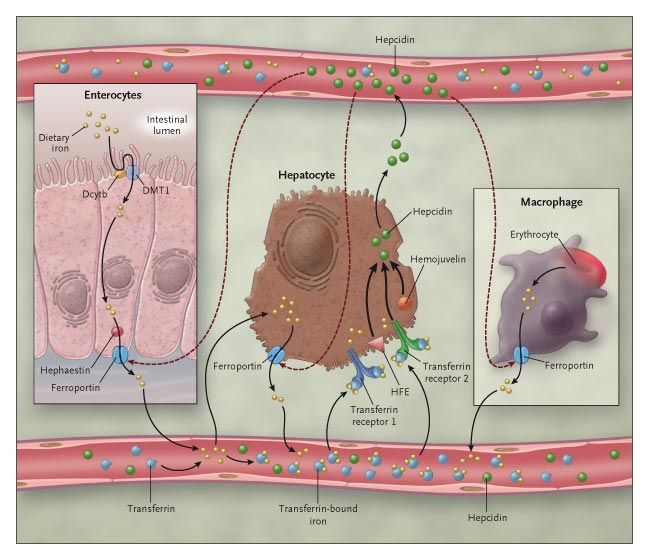
Controllo livelli di ferro
|
 |
Anemia sideropenica
• • •Anemia microcitica |
•Terapia
orale –Solfato ferroso –200 mg/die •Terapia e.v. –Ferro destrano, ferro sodio gluconato –Solo se inefficace os •Anafilassi •Reazioni anafilattoidi |
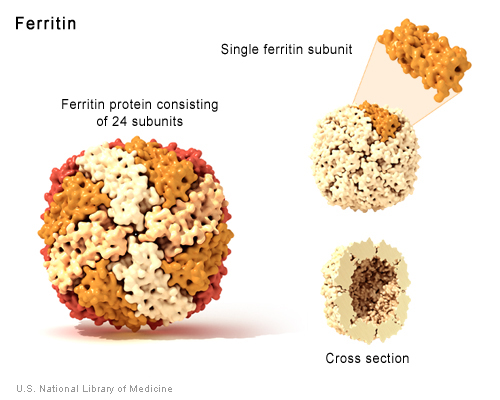
Sovraccarico di ferro
•2-10 g dose letale (bambini) •Trasfusioni, supplementi dietetici, utensili –accumulo ferritina •emosiderina – •Dolori addominali, gastrite erosiva, danno epatico,acidosi, shock •Terapia –lavanda gastrica –deferoxamina |
 |
Reazioni allergiche da metalli
Farmaci chelanti
•competizione con ligandiendogeni
–donatori di elettroni
•Legame di coordinazione
–formazione di anelli eterociclici
•Più stabili dei ligandiendogeni
– maggiore affinità per
il tossico
•Antidotismo
•Preservate strutture biologiche (enzimi, membrane)
–bassa affinità per i metalli essenziali
•Ca2+, Zn3+
–distribuzione in compartimenti contenenti il metallo
–allontanamento del complesso
Dimercaprolo
•2,3-Dimercaptopropanolo, BAL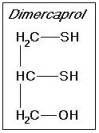
–10 % in olio di arachidi
–Intramuscolo
–Eliminazione renale
•dissociazione in urina tubulare
•tossicità renale
•Intossicazione da arsenico, mercurio, piombo
•Effetti sfavorevoli
–Dolore, nausea, ipertensione, trombocitopenia, disturbi
della coagulazione
–RidistribuzioneAse Hg al SNC
Succimer
•Acido dimercaptosuccinico, DMSA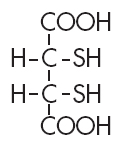
–Acido dimercaptopropansulfonico, DMPS
•Analoghi del dimercaprolo
–Migliore indice terapeutico
•Assorbimento orale
–Legame a cisteina
•Disolfuro misto
–Escrezione biliare e urinaria
•Azione chelanteper Pb, Hg, As
•Effetti sfavorevoli
–Disturbi GI, aumento transaminasi, neutropenia
Penicillamina
•D-Dimetilcisteina
–Meno tossico di L-isomero
–Chelanterame
•morbo di Wilson
•N-acetilpenicillamina
–Intossicazione da mercurio ed altri metalli
•Altri impieghi
–Artrite reumatoide, cirrosi biliare, sclerodermia,
cistinuria
•Biodisponibilitàorale
–Interferenza con cibi
•Effetti sfavorevoli
–Nefrotossicità
–Pancitopenia
–Ipersensibilità
•Allergia crociata con penicillina
Deferoxamina
•Intossicazione da ferro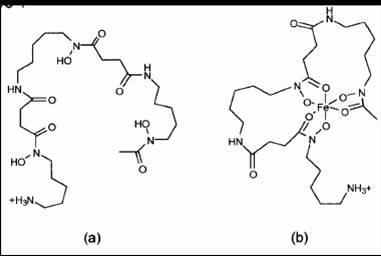
–alta affinità per Fe in ferritina, emosiderina
–bassa affinitàper ferro in citocromi, emoglobina
•Somministrazione parenterale–e.v. lenta, i.m.
–deferiproneattivo per os
•Escrezione urinaria
•Effetti avversi
–anafilassi
–difficoltàrespiratoria
–neurotossicità
EDTA
•Etilendiaminotetraacetato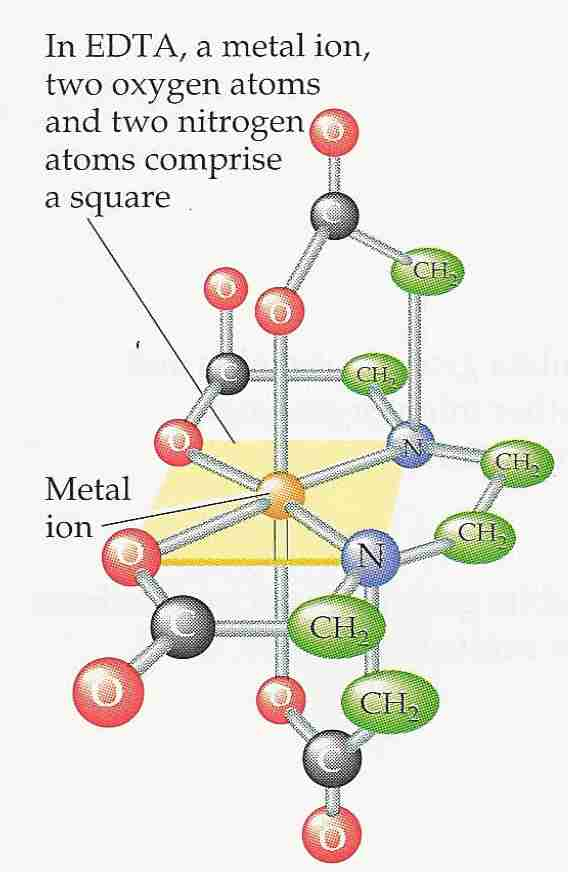
–sale sodico ![]() ipocalcemia
ipocalcemia
–sale disodico-calcico
•intossicazione da piombo
•chelante extracellulare
–somministrazione parenterale
•e.v. lenta, i.m
•scarsamente assorbito per os
–escrezione urinaria
•Effetti sfavorevoli
•nefrotossicità tubulare
Per scaricare il documento completo sulla tossicologia dei metalli pesanti clicca qui